CTC是肿瘤血行转移的“种子”。
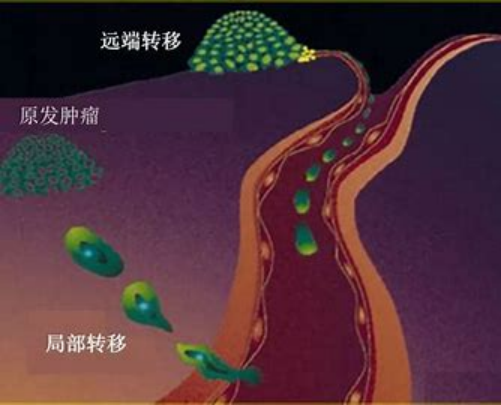
2014年,美国FDA批准强生公司“CellSearch®”上市,开启CTC临床应用新篇章。至今,已历经三个时代。
CTC 1.0时代
FDA批准CellSearch®上市,计数EPCAM阳性上皮细胞,用于肠癌、乳腺癌和前列腺癌预后判断。国内外专家共识和指南把CTC作为肿瘤TNM外一个分期新指标。
随2017年CellSearch®退市,“CTC1.0时代”黯然落幕。
CTC 2.0时代
重点聚焦CTC免疫表型和分子分型,用于靶向药物或免疫药物伴随诊断,迭代至“CTC2.0”。该类产品灵敏度显著提升,但整体操作复杂、周期长、重复性差,临床获益不足。虽有国内外指南或专家共识提及CTC意义,但临床使用范围仍然非常局限。
迄今为之,没有一个CTC2.0类产品获得FDA、NMPA批准。
CTC3.0时代
通过AI扫描识别,CTC三合一分离技术大幅度提升检测效率,降低操作难度;CTC-NGS测序深度揭示转移细胞的分子信息;体外培养CTC,是耐药患者唯一的个性化体外试药机会,CTC应用拓展早诊、治疗、转移和复发的肿瘤全病程管理。
2023年,以为臻生物自主研发“尺寸过滤+阴性排除+阳性富集”CTC分离捕获仪CellSortingTM为依托,具有"AI阅片+少量细胞NGS测序+体外培养"三大特征。

从CellSearchTM原代计数(CTC1.0)开始,到膜过滤等物理方法或磁珠微流控捕获方法,关注计数的同时更关注CTC细胞表面蛋白和分子分型(CTC2.0),直到为臻生物领行业之先,建立以“人工智能+scSEQ+体外培养”为标准的CTC3.0,覆盖早诊、治疗、转移和复发等肿瘤病程管理的全程。
“CTC3.0”,度微医学新定义
—— 人工智能 + scSEQ + 体外培养
至此,CTC3.0时代来临!
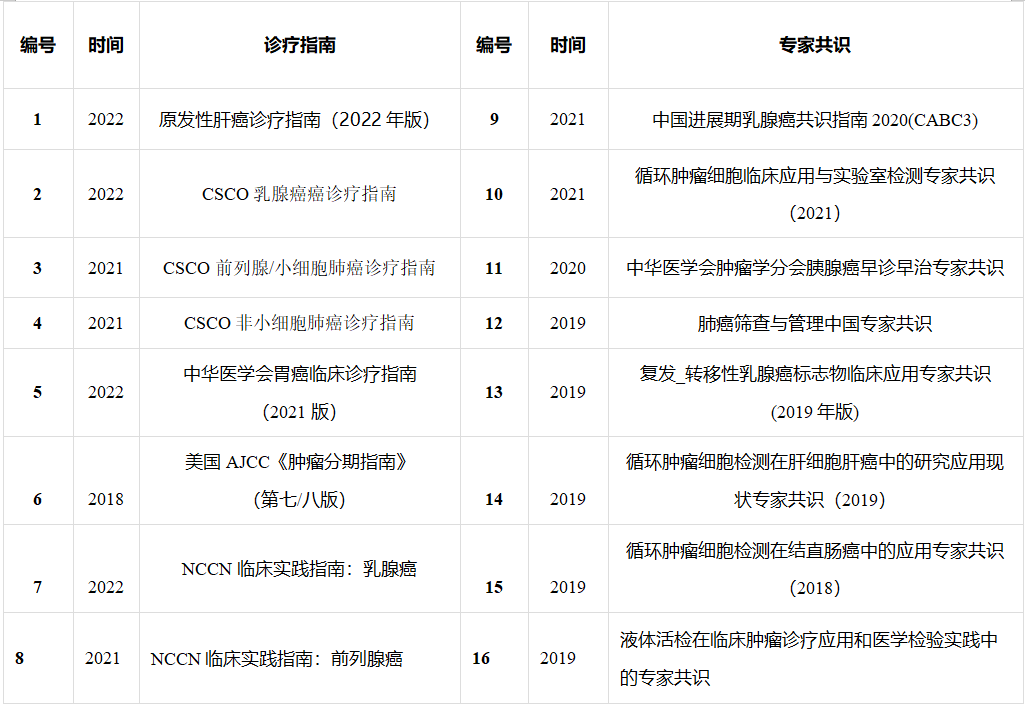
CTC相关肿瘤临床诊疗指南和专家共识见下表
欢迎合作,请联系:15862368601 (微信同号),李先生
